Notch シグナル伝達系
1. 中枢神経系の初期発生
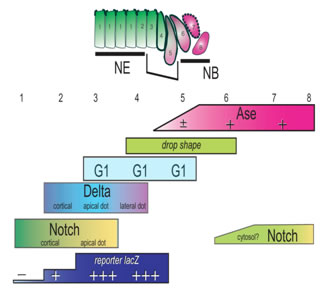
神経上皮幹細胞から神経前駆細胞への細胞周期依存的転換機構の解析 これまで我々は,哺乳類神経上皮幹細胞から前駆細胞へと分化する際の分子制御機構を明らかにするモデル系として,ショウジョウバエの視覚中枢原基に存在する神経上皮幹細胞を選び,それらが細胞周期特異的-神経上皮幹細胞において特異的に延長しているG1期に神経前駆細胞に転換することを明らかにしてきた.そこでこの転換機構を制御している分子メカニズムを明らかにするために,Notch signalingの関与について解析した。Notch signalingが神経上皮幹細胞と神経前駆細胞の増殖を促進し,かつ神経前駆細胞からニューロン・グリアへの分化を抑制することは,これまでの我々の研究で明らかにしているが,神経上皮幹細胞から神経前駆細胞への転換の分子機構に関しては,哺乳類を含めて何も明らかになっていない。実際ショウジョウバエ視覚中枢原基の神経上皮幹細胞においても,その神経前駆細胞への転換プロセス中の細胞は,G1期であるためBrdUを取り込まない上に,細胞接着装置の,細胞極性の再構築が起こるのだけが指標でbHLH型転写因子のAsense が転換後半に徐々に発現してくること以外には適当な分子マーカーもなく解析が困難だった。Notch signalingの活性化の指標であるsu(H)遺伝子のプロモーター支配下でβ-gal遺伝子を発現するレポーター遺伝子の発現を調べることでNotch signalingが神経上皮幹細胞から神経前駆細胞への転換の直前に活性化され,直ちにダウンレギュレートされることを明らかにした。さらにNotchの機能欠失突然変異体のクローンを作成することで神経上皮幹細胞の転換直前にNotch signalingの活性が上昇できない様にするとNotch signalingのリガンドであるDeltaの異所的な蓄積が起こり転換プロセスが早まる事がわかった。以上のことからNotch signalingの活性化が神経上皮幹細胞から神経前駆細胞への転換直前の限定された時期に起こることで神経上皮細胞から神経前駆細胞への転換のタイミングが正しく制御されているのだと言うことを示した。
。 
高等動物の場合、出生児の未成熟な脳が環境から影響を受け神経活動依存的に回路が成熟する『臨界期』とよばれる時期を経て成人型の脳へと発達する。
こうした神経活動依存的に回路が成熟する可塑性の基盤となるメカニズムについては、哺乳類視覚系、体性感覚系などで理解が進んできている。
近年、活動依存的に活性化される様々シグナル伝達系の存在も次々と明らかになってきているが、それらのシグナル伝達系は胚の初期発生過程においては、
幹細胞あるいは未分化な前駆細胞から神経細胞への分化に関わっており、神経細胞に分化した後の機能分化にも働いていることを意味している。
すなわち、神経細胞の機能分化においても発生過程同様のシグナル伝達系の統合的な調節機構が働いている可能性が高い。
そこで我々は、体性感覚野の発達期に見られる回路形成をモデルとして、種々のシグナル伝達系が神経細胞の活動依存的機能分化に関わるメカニズムを
明らかにすることを目的として研究を行っている。
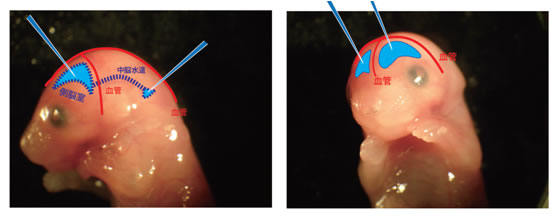
<方法>子宮内電気穿孔法による遺伝子導入
胎生14.5日のICR マウス子宮内の胎仔の脳室にFastGreen で着色した
CAG-EGFP 発現ベクター0.25μg を含むプラスミド溶液をマイクロキャピ
ラリーを使って注入し、子宮内胎仔の脳に対して75 ~ 90 度の方向で当
てた電極を使って(上図)45V 50msec の電気パルスを450msec の間隔
で5 回加えることで遺伝子導入を行った。その後、母体に戻した胎仔を正
常分娩で出産させ、P0~P21 まで発生させた。
<業績リスト>
Endocr J. 2019 Mar 6. doi: 10.1507/endocrj.EJ18-0441. [Epub ahead of print]
1)Kei Hori, Taku Nagai, Wei Shan, Asami Sakamoto, Shinichiro Taya, Ryoya Hashimoto, Takashi Hayashi, Manabu Abe, Maya Yamazaki, Keiko Nakao, Tomoki Nishioka, Kenji Sakimura, Kiyofumi Yamada, Kozo Kaibuchi and Mikio Hoshino
Cytoskeletal Regulation by AUTS2 in Neuronal Migration and Neuritogenesis
Cell Rep. 2014 Dec 24;9(6):2166-2179. doi: 10.1016/j.celrep.2014.11.045. Epub 2014 Dec 18.
2)Orihara M., Toriya M., *Nakao K. and Okano H.Downregulation of Notch mediates the seamless transition of individual Drosophila neuroepithelial progenitors into optic medullar neuroblasts during prolonged G1
Devlopmental Biology 351(1):163-75 (2011)
(*Nakao K. is a corresponding author.)
3)Ozawa Y, Nakao K, Kurihara T, Shimazaki T, Shimmura S, Ishida S, Yoshimura A, Tsubota K, Okano H.
Roles of STAT3/SOCS3 pathway in regulating the visual function and ubiquitin-proteasome-dependent degradation of rhodopsin during retinal inflammation.
J Biological Chemistry 283:24561-24670 (2008)
4)Ozawa Y, Nakao K., Shimazaki T, Shimmura S, Kurihara T, Ishida S, Yoshimura A, Tsubota K, Okano H.
SOCS3 is required to temporally fine-tune photoreceptor cell differentiation.
Dev Biol. 303(2):591-600 (2007). Epub 2006 Dec 1.
5)Toriya M., Tokunaga A., Sawamoto K., Nakao K.* and Okano H.*(*Correspondence)
Distinct functions of human Numb isoforms revealed by misexpression in neural stem cell lineage in the Drosophila larval brain.
Dev. Neurosci. 28(1-2):142-55 (2006)
6)Kohyama J., Tokunaga A., Fujita Y., Miyoshi H., Nagai T., Miyawaki A., Nakao K., Mastuzaki Y. and Okano H.
Visualization of spatio-temporal activation of Notch signaling: live monitoring and significance in neural development.
Dev. Biol. 286:311-325 (2005)
7)Ozawa, Y., Nakao, K.., Shimazaki, T., Takeda, J,, Akira, S., Ishihara, K., Hirano, T., Oguchi., Y. and Okano, H.
Downregulation of STAT3 activation is requires for presumptive rod photo receptor cells to differentiate in the postnatal retina.
Molecular and Cellular Neuroscience 26(2):258-270 (2004).
8)Tokunaga, A. Kohyama, J., Nakao, K. Sawamoto, K. and Okano, H.
Mapping spatio-temporal activation of Notch signaling during neurogenesis and gliogenesis in the developing mouse brain.
J. Neurochemistry 90(1):142-154 (2004).
9)Yoshida, T., Tokunaga, A., Nakao, K and Okano, H
Distinct expression patterns of splicing isoforms of mNumb in the endocrine lineage of developing pancreas.
Differentiation 71(8):486-495 (2003).
10)Kishi N, Tang Z, Maeda Y, Hirai A, Mo R, Ito M, Suzuki S, Nakao K, Kinoshita T, Kadesch T, Hui C,Artavanis-Tsakonas S, Okano H, Matsuno K.
Murine homologs of deltex define a novel gene family involved in vertebrate Notch signaling and neurogenesis.
Int. J. Dev. Neurosci.:19(1):21-35 (2001).
11)Castella, P., Sawai,S., Nakao, K.,Wagner, J.A. and Caudy, M.
Hes1 represses both transcription repression and proliferation in PC12 cells:
A role for the Helix III/IV domain in transcription repression
Molecular Cellular Biol. 20(16):6170-83 (2000).
12)Nakao, K and Campos-Ortega, J. A.
Persistent expression of genes of the enhancer of split complex suppresses neural development in Drosophila.
Neuron 16(2):275-86(1996).
【教科書】
再生と組織幹細胞
動物の事典
2015年 朝倉書店
マウス神経の発生と再生
再生医療のための発生生物学 浅島誠、赤池敏宏編
2006年 コロナ社